
I meccanismi dell’insulino-resistenza e come invertirli
Siamo arrivati finalmente al punto cruciale di questa serie legata all’insulina e ai meccanismi di insulino-resistenza, ora descriverò quei meccanismi complementari che ci aiuteranno a chiudere il quadro.
Ho deciso che data l’importanza di questo articolo lo scriverò tutto in maniera semplice senza andare nei tecnicismi, cercherò di spiegare solamente i meccanismi patologici che si instaurano su quelli fisiologici che abbiamo visto fino adesso, descrivendo come i 3 tessuti target reagiscono ad una insulino-resistenza progressiva che poi sfocia in un diabete di tipo 2.
Allego un grafico che mostra la storia naturale della malattia, per storia naturale si intende la patologia lasciata andare senza intervento medico.
In una prima fase avremo un aumento del carico di insulina necessario a gestire una certa quantità di glucosio, la fase si definisce iperinsulinica-euglicemica.
In questa fase il nostro organismo compensa la minore sensibilità dei tessuti all’insulina aumentandone la produzione.
Ovviamente la fase successiva è quella in cui anche l’aumento dell’insulina non è più sufficiente, e poi andremo a vedere perché, quindi avremo una fase in cui ci sarà iperinsulinemia e iperglicemia.
Questa fase poi porta ad una perdita delle cellule b produttrici di insulina, quindi avremo un calo della produzione di insulina irreversibile, che renderà necessario l’utilizzo di insulina esterna in maniera sovrapponibile al diabete di tipo 1.
Ad oggi sono stati introdotti farmaci che riescono a ridurre di molto questo fenomeno, che è il punto di non ritorno oltre al quale non è possibile più fare nulla.
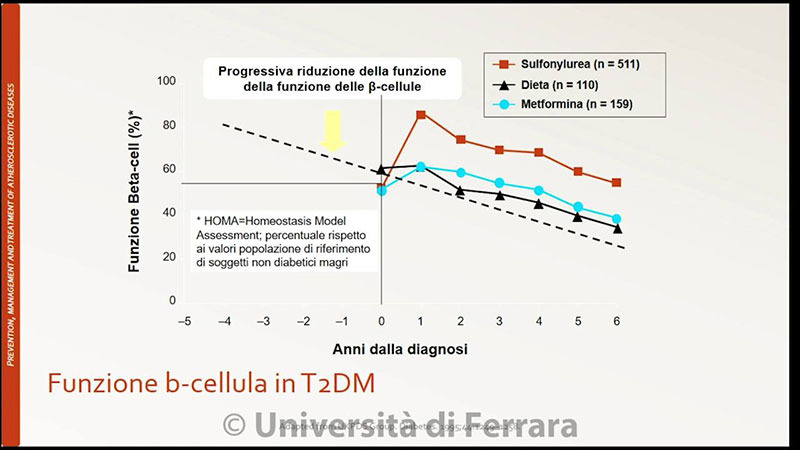
La medicina funzionale cerca di intervenire il prima possibile, il top ovviamente è evitare che questi meccanismi si instaurino, ma se la persona dovesse decidere di iniziare un percorso di recupero del DM2, tanto più precocemente interviene e tanto meglio è, perché persa la produzione di insulina non si torna più indietro.
In tutti i tessuti che espongono l’INSR sotto la pressione di quantità cronicamente elevate di insulina i meccanismi di internalizzazione e ubiquitinizzazione del recettore che abbiamo visto in precedenza sono estremamente favoriti, in pratica il recettore viene internalizzato e distrutto fino ad essere sempre meno disponibile in membrana per il legame con l’insulina, in pratica inibendo il segnale dell’insulina stessa.
Ad oggi gli studi più recenti ci dicono che per arrivare al meccanismo patologico i recettori espressi devono essere il 10% del fisiologico, che significa perderne il 90%. Aggiungo una mia considerazione, che già con un 30% residuo si intravedono i segni di iperinsulinemia reattiva, ma teniamo per buono il dato sperimentale.
Vediamo adesso quali sono i meccanismi che si instaurano nei vari tessuti target.
Insulino-resistenza nel muscolo
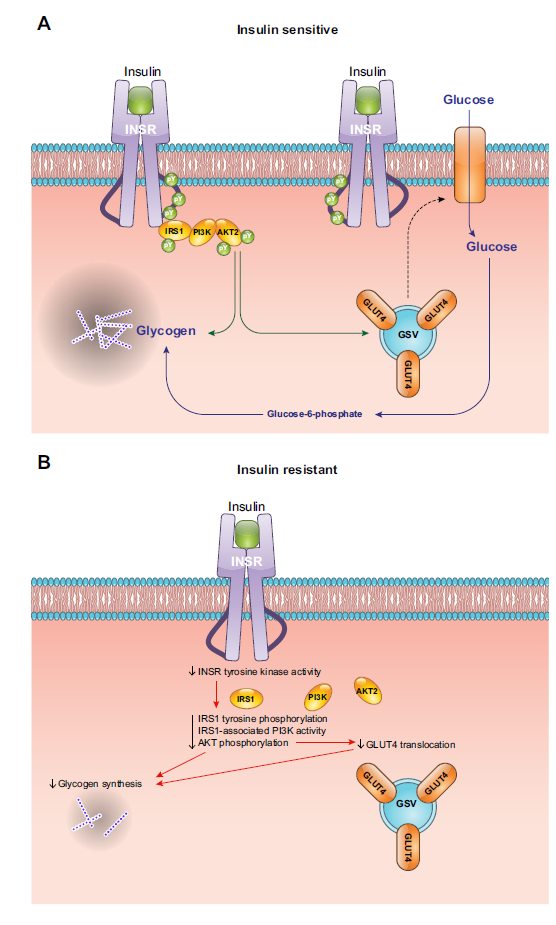
Come abbiamo visto nel muscolo il meccanismo di up-take del glucosio in base alla risposta insulinica è determinato dalla migrazione del GLUT4 in membrana, sotto IR (insulino resistenza da ora in poi) il GLUT4 non viene esternalizzato, quindi il glucosio perde la sua autostrada per entrare nella cellula.
Abbiamo visto come l’insulina regoli anche la sintesi di nuovo glicogeno, che quindi viene inibita dall’assenza di azione dell’insulina.
Ci troveremo quindi un muscolo che non è in grado di assorbire glucosio, scarico dal punto di vista energetico e senza riserve, per cui un muscolo privo di energia sarà più affaticabile e cercherà di ossidare altri substrati come i corpi chetonici o gli acidi grassi.
Purtroppo il muscolo è il primo tessuto vittima di IR, e se pensiamo alla massa muscolare scheletrica, possiamo immaginare che il grosso del glucosio in realtà sia destinato al muscolo e una sua mancata clearence del glucosio sia un grosso fattore che poi determini meccanismi patologici.
Ovviamente esiste un motivo fisiologico per il quale la cellula deve evitare l’eccesso di glucosio, anzi ne esistono 2:
- fattore osmotico, il glucosio ha un importante ruolo osmotico, per questo motivo viene convertito in glicogeno, o in amido dalle piante, una sola enorme molecola pesa a livello osmotico assai meno che tante piccole molecole. Ma esiste un limite anche alla quantità di glicogeno stoccabile, per cui una volta che le riserve sono piene non ha senso esporre il recettore per l’insulina alla richiesta di nuovo glucosio.
- fattore energetico, la quantità di glucosio, piruvato e ATP disponibili regolano i processi energetici della cellula, un eccesso di tutti questi substrati alterano le reazioni ossidative e possono portare ad una perdita in efficienza metabolica con accumulo di ROS e danni
IR nel fegato
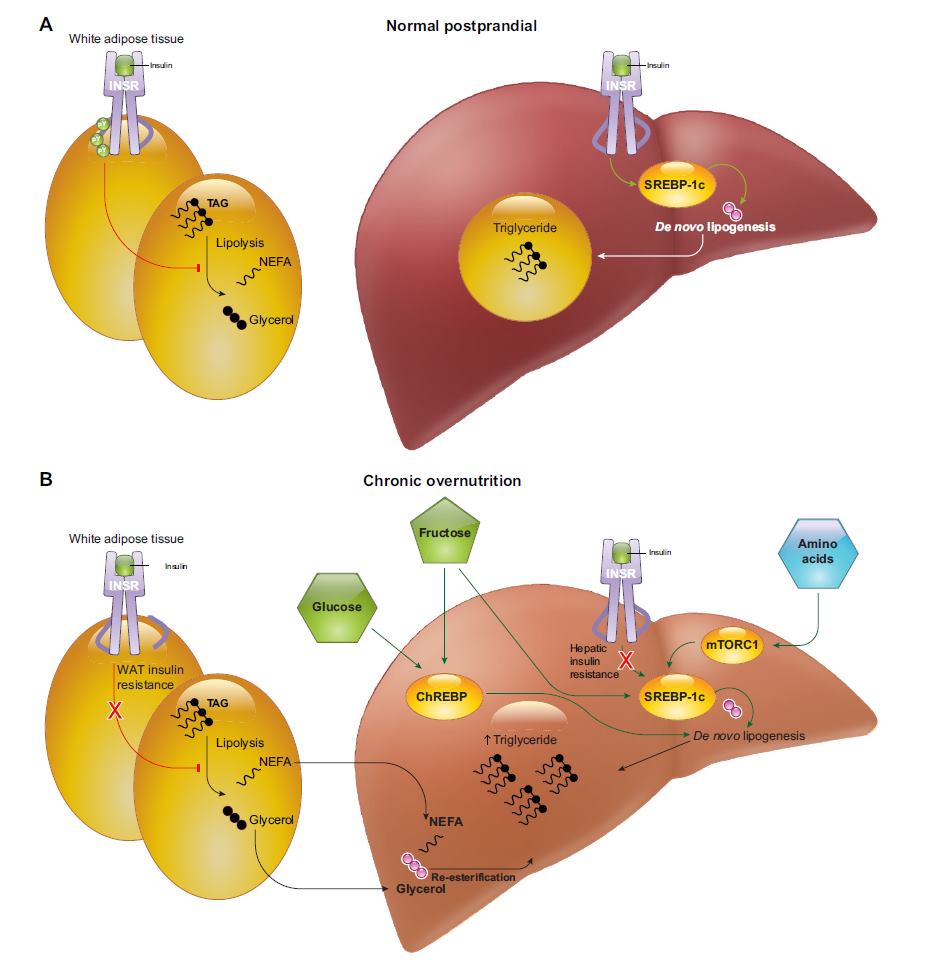
Nel fegato i meccanismi sono estremante importanti, e potremmo stare a descriverli in 30 pagine, ma cercheremo di essere brevi e diretti.
Il fegato passa il suo tempo a produrre glucosio, come abbiamo visto attraverso la glicogenolisi (rottura del glicogeno) e della gluconeogenesi (creazione di glucosio da parte di substrati non glucidici che sono glicerolo e aminoacidi).
Uno dei principali compiti dell’insulina è spegnere la produzione e la messa in circolo di glucosio, e ovviamente uno dei segnali di sordità insulinica è la non capacità di regolare questo processo.
La glicemia a digiuno nel diabete è elevata proprio perché il fegato continua ad emettere glucosio in circolo.
La perdita di sensibilità all’insulina vedremo che aumenta la quantità di glicerolo circolante e impedisce al fegato di iniziare i processi di stoccaggio, quindi aumentare la glicogenosintesi ed interrompere la gluconegenesi.
Il fegato a livello di gestione del glucosio è molto particolare, l’ingresso del glucosio è indipendente dall’insulina, e tutto il sistema enzimatico è composto da enzimi che possono lavorare anche in eccesso di glucosio, quindi rispetto all’esochinasi, abbiamo la glucochinasi, che è in grado di fosforilare il glucosio senza essere inibita dal suo eccesso, per cui il fegato rimuove una enorme quantità di glucosio dal circolo, ma come abbiamo visto è sottoposto agli stessi limiti osmotici delle altre cellule, quindi una parte diverrà glicogeno, ma dall’altra l’unica soluzione è produrre acidi grassi, visto che non richiamando acqua sono osmoticamente inerti.
Nasce quindi il meccanismo del fegato grasso non alcolico, o steatosi epatica non alcolica. L’accumulo di grasso nel fegato è uno dei principali segnali di IR, e anche nel soggetto magro diabetico è assolutamente normale vedere il classico aspetto del fegato steatosico.
Ovviamente all’aggravarsi della steatosi il parenchima epatico ne viene danneggiato, portando ad una progressiva perdita di funzionalità dell’organo.
Ora sappiamo che quando si riesce ad invertire l’IR la steatosi è reversibile, infatti l’ecografia al fegato nei soggetti diabetici sta sempre più entrando nella routine diagnostica per valutare i quadri patologici.
Ovviamente anche la sintesi di colesterolo sotto insulino-resistenza è aumentata, visto che l’insulina regola anche l’HMG-CoA reduttasi, è normale per un soggetto IR avere l’LDL alto e spesso anche gli altri lipidi plasmatici.
IR nel tessuto adiposo

Sfortunatamente per noi il tessuto adiposo è l’ultimo tessuto che sviluppa IR, ragion per cui il diabete favorisce un forte accumulo di grasso, visto che è l’unico tessuto sensibile quando gli altri sono diventati resistenti, tutto il glucosio finisce lì e si sviluppano i classici ingrassamenti da IR, che sono il giro vita, l’omento, il grasso viscerale, la steatosi e anche l’aumento del tessuto adiposo intramuscolare che normalmente ha ruolo energetico di riserva o di cuscinetto.
Vengono ovviamente alterati i processi di lipolisi e liposintesi, si assiste ad un aumento dei livelli di tutti i lipidi plasmatici.
Sappiamo inoltre che il grasso non è un tessuto inerte, un eccesso adiposo spesso si accompagna alla produzione di adipochine infiammatorie che sono un ulteriore driver di insulino-resistenza, così come lo sono in generale le citochine infiammatorie.
Ora come avete certamente capito, questo stato procede sempre in maniera degenerativa fino a quando si svilupperanno le classiche sindromi da DM2, con sintomi caratteristici:
- maculopatia
- nefropatia
- neuropatia periferica
- neuropatia autonomica
- piede diabetico
- etc, etc.

Ad oggi circa il 60% del budget sanitario è destinato al trattamento del diabete e delle sue complicanze, perché come potete immaginare una tale alterazione metabolica comporta poi un incredibile aumento di moltissime altre patologie, ischemiche, tumorali legati all’infiammazione cronica e ai fattori di crescita legati all’insulina, neurodegenerative come le demenze…
Per fortuna l’OMS sta venendo verso la nostra direzione e con la carta di OTTAWA ha iniziato a staccarsi dalla visione farmacocentrica per andare verso una direzione in cui dieta ed esercizio fisico siano primarie, e con una certa ragione, visto che la giusta alimentazione e il giusto esercizio fisico hanno effetti incredibilmente potenti e possono essere simbiotici ai farmaci per un recupero precoce della malattia, o essere risolutivi in assenza di trattamento farmacologico in tantissimi altri casi.
Decalogo pratico per gestione IR
Metto una serie di regole e comportamenti che ad oggi sono visti come il gold-standard aggiornati con la nostra esperienza di medicina funzionale.
- Il deficit calorico, un lieve deficit calorico che NON DEVE INNESCARE MECCANISMI STRESSOGENI, si è visto essere l’ideale, un fabbisogno calorico di 200-300 calorie in meno al giorno è già un importante driver di recupero della sensibilità insulinica. È molto importante non andare oltre perché tanto maggiore è il gap calorico e tanto più cortisolo verrà prodotto, andando poi a peggiorare la sensibilità all’insulina anche in regime ipocalorico. Un eccessivo deficit altera anche la produzione di RT3, con un rallentamento metabolico generale.
- Una adeguata suddivisione dei macronutrienti, sebbene anche altri regimi come la chetogenica possano funzionare, si è visto che la migliore soluzione è quella zonica/parazonica. La zona prevede una suddivisione di 40/30/30, quindi 40% calorie dai glucidi, a basso indice glicemico preferenzialmente, un 30% di proteine di buon valore biologico ed un 30% dai grassi principalmente monoinsaturi ed omega3. Nella zona anche la gestione dei pasti e degli spuntini evita grandi picchi glicemici e dà una grande stabilità ormonale, che si è visto nel medio-lungo periodo essere la maniera migliore di gestire l’IR. Tra l’altro la zona nel calcolo dei blocchi è spesso quel giusto ipocalorico che la rende ideale anche nel profilo del calcolo calorico.
- L’attività fisica. Si è visto che da sola l’attività fisica è la più importante arma contro il diabete di tipo 2. Tutti gli studi fatto concordano che 150/180 minuti di attività settimanale moderata/sostenuta, parliamo di camminata a passo veloce, running lento, pedalare e nuotare sono già più sufficienti per recuperare la sensibilità all’insulina. Un ulteriore step sarebbe inserire almeno 2 sessioni di lavoro di forza fatto con pesi o con il peso del corpo. Un programma molto bello che ho visto si chiama “pillole di esercizio”, in cui una app sul cellulare fatta come un blister di farmaco prevede la somministrazione di 10 minuti di esercizio come unità farmacologica ed entro il fine settimana occorre completare tutto il blister.
- L’uso di antiossidanti, l’evitare i danni da ROS sulle membrane da una parte preserva i recettori, dall’altra diminuisce la produzione di citochine infiammatorie che aumentano l’IR. Quindi glutatione, q10, ALA, e EPGCG si è visto essere molto efficaci abbinati alla dieta e all’esercizio.
- Il dimagrimento, il perdere peso è un ottimo rimedio per l’IR, il perdere peso mette l’organismo nel setting catabolico adeguato per il recupero della sensibilità insulinica.
- Il combattere l’infiammazione, tenere basse tutte le citochine infiammatorie, quindi l’uso di omega 3 in primis, migliora di molto i profili infiammatori che sono molto legati all’insulinoresistenza.
- Il sonno e lo stress, dormire 8 ore a notte significa mantenere al minimo i livelli di cortisolo, lo stress e la mancanza di sonno sono tra i primi fattori che impattano sull’IR. Si sono fatti moltissimi studi che hanno visto che dopo una notte con 4 ore di sonno tutti i parametri di risposta all’insulina peggiorano in maniera incredibile, per cui il dormire bene è uno dei primi fattori che preservano la giusta sensibilità. Per lo stress cronico vale lo stesso discorso.
- La costanza, ogni volta che si entra in un regime yo-yo la volta successiva sarà sempre peggio, occorre trovare un regime salutare sostenibile che possa essere mantenuto life-time, a maggior ragione nei soggetti che hanno tendenza all’IR, e bene o male basta guardare i propri genitori, se sono diabetici è assai probabile che la tendenza familiare sia simile per tutti. Per queste persone che sanno essere più sfortunati sotto questo aspetto è necessaria una particolare attenzione in fase preventiva.
- Tenere bassa l’omocisteina, l’omocisteina elevata è un importante driver infiammatorio, spesso ignorato dalla classe medica, ma gioca un ruolo assai importante, soprattutto nell’infiammazione endoteliale, quindi quella dei vasi legata a processi aterosclerotici, oltre ad essere un indicatore di non perfetta efficienza metabolica.
- Il digiuno, se ben programmato e con le giuste valutazioni dell’outcome saltare qualche pasto massimizza l’esposizione dell’INSR, parlatene con chi vi segue, non fate da soli, ma in un contesto alimentare ben strutturato il saltare qualche colazione può dare facilmente una finestra di 16 ore senza cibo che possono aiutare nel recupero della sensibilità. Per mio pensiero non abuserei del digiuno, resto dell’idea che la zona sia il miglior approccio possibile, però se ben inserito può essere un’arma in più.
Altri meccanismi di azione dell’insulina
Vorrei toccare alcuni punti che non sono di primo pensiero quando si pensa all’insulina, ma sono comunque fondamentali per inquadrare al meglio questo ormone che ha funzioni così complesse e variegate.
Ci soffermiamo su 3 aspetti:
- L’insulina ed il glucagone
- L’insulina e lo stress ossidativo
- L’insulina e l’appetito
Insulina e Glucagone
L’ormone antagonista per eccellenza dell’insulina è il glucagone, come l’insulina ha lo scopo di abbassare la glicemia, così il glucagone invece ha lo scopo di mantenere la glicemia a seguito di fasi di digiuno o di attività fisica che comportato il consumo di glucosio.
Il glucagone è prodotto dalle cellule alfa di Langherans, che sono isolette cellulari vicino a quelle beta che producono insulina. Queste cellule presentano recettori INSR per l’insulina, una volta che l’insulina viene secreta, con il segnale di glicemia alta, allora il glucagone non è necessario, anzi, quindi la sua produzione viene interrotta proprio dall’azione dell’insulina su questi recettori.
Nella situazione fisiologica l’insulina ha un effetto paracrino sulle isole alfa, esplica la sua azione proprio per la vicinanza tra le due popolazioni cellulari.
Quando un diabetico inietta insulina ovviamente la distribuzione dell’insulina nell’organismo è molto diversa da quella fisiologica, che privilegia per concentrazione il fegato e le cellule alfa, ed è uno dei motivi per cui la terapia insulinica non è facile da programmare.
La resistenza all’insulina dei recettori delle isole alfa è uno dei motivi per cui il segnale glucagone mantiene una certa glicogenolisi anche in abbondanza di glucosio circolante.
Insulina e Stress Ossidativo
Sappiamo che il driver principale che porta ad insulino-resistenza è un eccesso cronico di nutrienti, siano essi glucidici o lipidici.
Ci sono complessi meccanismi che spiegano che anche diete in eccesso di lipidi e normoglucidiche portano ad insulino-resistenza, con meccanismi diversi rispetto a quella che si sviluppa all’eccesso cronico di zuccheri.
Si è visto in numerosi studi che la beta-ossidazione, soprattutto nel soggetto diabetico comporti una produzione di ROS molto più elevata che nel normale ciclo di Krebs, e che il maggiore stress ossidativo che ne deriva danneggi i mitocondri, il reticolo endoplasmatico, e mette in moto dei meccanismi di stress reticolare che comportano una diminuzione della qualità e della quantità delle varie proteine di membrana.
https://www.nature.com/articles/emm2016157
(La beta-ossidazione è la via metabolica con cui vengono bruciati gli acidi grassi)
Il maggior stress ossidativo è poi un trigger per il sistema immunitario, che in elevata presenza di radicali liberi produrrà soprattutto IL1b, con ulteriore peggioramento della sensibilità insulinica.
L’uso di antiossidanti, sebbene le evidenze in letteratura siano deboli, sembra avere un effetto benefico su questo aspetto dell’insulino-resistenza.
Insulina ed Appetito
Nell’ipotalamo ci sono nuclei specifici che servono a regolare l’appetito, queste cellule sono provvisti di recettori specifici per molte molecole, leptina, adiponectina etc. etc, ma tra gli altri un segnale di sazietà molto importante viene proprio dall’insulina.
L’anormale sensibilità di queste cellule determina una perdita di controllo dell’appetito, spesso nel senso di aumento dello stesso.
Nel soggetto insulino-resistente, spesso obeso, è piuttosto comune trovare resistenza sia alla leptina che all’insulina, con un forte appetito che non è più adeguato al reale apporto calorico.
Come sono connessi il cortisolo e l’insulina?
Trattiamo ora uno dei meccanismi chiave nello sviluppo dell’obesità e dell’insulinoresistenza da stress.
Sappiamo ormai benissimo che il cortisolo è l’ormone chiave di risposta allo stress, in un ancestrale meccanismo di sopravvivenza, quando siamo in pericolo il nostro sistema endocrino lavora per destinare una maggiore quantità di energia ai muscoli e alle funzioni che ci aiutano a toglierci di impaccio.
Il cortisolo, soprattutto nella sua acuta increzione, favorisce la lipolisi, aumenta il catabolismo muscolare, la liberazione di glucosio da parte del fegato, e in pratica ci consente di avere quel QUID in più che può fare la differenza tra il fuggire da un predatore o l’essere raggiunti e divorati.
Si è visto infatti che uno stimolo ACUTO di cortisolo migliora l’insulino-resistenza e paradossalmente accelera sia il metabolismo che il ricambio muscolare, ed è infatti una delle chiavi nel miglioramento della performance dopo allenamento.
I problemi con il cortisolo iniziano quando la sua alterazione diventa cronica, quando siamo sottoposti ad uno stress, metabolico, infettivo, psichico, emozionale, che ci porta ad avere costantemente una secrezione di cortisolo più alta del normale e che non segue più il ritmo circadiano, visto che la variabilità di concentrazione del cortisolo nelle 24 ore è fondamentale per lo svolgimento delle sue funzioni.

Sono stati svolti centinaia di studi, soprattutto su malati di morbo di Cushing, in cui per diversi motivi la secrezione di cortisolo è profondamente alterata ed enormemente aumentata nella giornata, e si è visto come il cronico eccesso di cortisolo sia un importante fattore per lo sviluppo di insulinoresistenza.
I ricercatori hanno cercato di capire quali fossero i meccanismi biochimici sottesi e le scoperte sono state davvero molto interessanti, e danno un sacco di risposte molto utili anche per la programmazione di un corretto regime alimentare per ottenere dei duraturi effetti sulla salute.
Vorrei anche sottolineare il fatto che la classica forma del soggetto che ingrassa per insulino-resistenza è molto simile a quella del soggetto che ingrassa per lo stress, quindi con adiposità viscerale, classicamente a mela, steatosi epatica, aumento del grasso muscolare e sviluppo di facies cushingoide, denotando un legame molto stretto tra i due fenomeni.
Vi metto una sola immagine, ma che in pratica dice tutto.
Si sono messi in luce 3 meccanismi che alla fine convergono in una unica via metabolica, la via di segnalazione di JNK, una chinasi estremamente importante, vi lascio qui un articolo che spiega il pathway nel dettaglio per chi vuole approfondirlo:
https://www.creative-diagnostics.com/JNK-Signaling…
- La via del 11Beta-HSD1, enzima chiave nell’attivazione dei glucocorticoidi
- La via del TNFalfa e dell’IL1B
- La via della regolazione recettoriale dovuta all’eccesso cronico di insulina, quella che abbiamo già abbondantemente visto fino ad adesso.
11BETA-HSD1
È un enzima chiave nella cellula di attivazione del cortisolo, che per poter aver la massima affinità con il recettore citoplasmatico passa attraverso questa deidrogenazione. Questo enzima è regolato da due cose:
- la quantità di glucocorticoidi presenti, siano essi endogeni o esogeni da terapia sistemica
- La quantità di insulina, soprattutto nell’adipocita, l’insulina regola a livello post trascrizionale la quantità di enzima trascritto.
Questo è lo studio che ad oggi ho trovato descrivere molto bene il meccanismo, lo lascio per chi vuole approfondire.
Cosa significa in termini pratici tutto ciò?
Che un eccesso di cortisolo cronico o un eccesso di insulina sovraregolano questo enzima portando ad insulino-resistenza, con aumento del tessuto adiposo soprattutto viscerale.
Effetto delle citochine infiammatorie sulla resistenza all’insulina
Il grasso viscerale non è un tessuto metabolicamente inerte.
Quando ingrassiamo gli adipociti stanno sempre più stretti, soffrono e producono segnali infiammatori. Nell’obeso si assiste ad una certa necrosi degli adipociti, oltre la aumentata apoptosi, le citochine che vengono prodotte, soprattutto paracrine come gli eicosanoidi infiammatori, attirano una classe specifica di macrofagi, che sono gli ATM o adipose tissue macrophages, una classe particolare che si distingue dai soliti per la particolarità della secrezione citochinica, producono infatti:
- TNF alfa
- IL1B
- Il6, che è una citochina strana, se messa in un contesto infiammatorio è infiammatoria, se prodotta dal muscolo a seguito dell’esercizio è antinfiammatoria ed è la protagonista dei benefici dell’attività fisica insieme all’irisina.
L’effetto combinato di cortisolo, eccesso insulinico e citochine infiammatorie determina una iperattivazione della via di JNK con la chiusura di un circolo vizioso che porta sempre più verso il diabete di tipo 2, ma per fortuna è un circolo che si può assolutamente spezzare, soprattutto se lo si fa precocemente.
Adesso che tutti i meccanismi sono stati messi nel piatto,
capite da dove nascono le indicazioni per affrontare al meglio questo meccanismo.
Se io dovessi decidere quale sia il meccanismo più importante da ottimizzare in una persona per garantire una buona qualità ed aspettativa di vita, probabilmente direi questo.
Sommario dei buoni consigli
Cerchiamo per chiudere di ribadire quali siano le migliori strategie per invertire l’insulinoresistenza con due premesse:
- Ci sono varianti genetiche delle proteine coinvolte nel signaling dell’insulina che rendono molto più proni a sviluppare diabete di tipo 2
- Affidatevi sempre ad un medico se sospettate di avere problemi con l’insulina e con la glicemia, e fatelo il prima possibile
- Il nutrizionista può essere il vostro migliore amico nella programmazione di un regime alimentare ideale.
- CERCATE UN MODERATO DEFICIT CALORICO: andate al massimo 3 o 400 calorie sotto il vostro fabbisogno quotidiano, un eccessivo deficit calorico attiverà quei meccanismi di risposta stressogena che ridurrà il recupero della sensibilità. Fasi di digiuno o di grossi deficit devono essere limitate nel tempo e messe in un piano con un preciso scopo.
- Bilanciate i macronutienti, si è visto che le diete migliori erano quelle con un rapporto tra i macronutrienti sono quelli zonici 40% calorie da carboidrati, a basso indice glicemico e ben sparsi nella giornata. il 30% dalle proteine di ottimo valore biologico ed il 30% dai grassi monoinsaturi, saturi a catena corta e omega3.
- Fate attività fisica, almeno 150 minuti di attività moderata a settimana come camminata veloce, corsa lenta, nuoto o pedalata abbinata ad almeno 2 sessioni di forza, con carichi o a corpo libero.
- Dormite almeno 8 ore a notte, qualità e quantità del sonno sono fondamentali per una buona sensibilità all’insulina.
- Tenete sotto controllo lo stress, per i motivi che abbiamo appena visto.
- Tenete sotto controllo l’infiammazione, omega 3, in primis, ma anche altri supplementi come la curcuma o la liquirizia possono aiutare.
- Tenete sotto controllo lo stress ossidativo, glutatione, lipoico, epigallocatechinagallato (nel the verde) e il q10 sono tutte sostanze che possono portare ad un drammatico aumento dell’efficienza della catena respiratoria, ad una migliore salute mitrocondriale e cellulare che si traduce in tessuti più integri e meno infiammati.
- Le abitudini sane sono abitudini per la vita, più sarà rigido e limitativo il sistema in cui vi infilate e prima lo mollerete, le abitudini sane devono essere facili da mantenere e diventare la nuova normalità.
- Se il vostro medico vi prescrive dei farmaci non abbiate paura ad usarli, l’iperglicemia può fare danni davvero importanti all’organismo, va assolutamente normalizzata il prima possibile e ad oggi c’è un armamentario farmacologico impensabile solo pochi anni fa.
Nella nostra esperienza abbiamo visto recuperi incredibili, persone che sono venute da noi sotto farmaci da anni che in pochi mesi in collaborazione con il diabetologo hanno scalato ed eliminato tutto in favore di dieta ed attività fisica, ripeto non sempre è possibile farlo, ma più siamo precoci e più è probabile poter gestire tutto con dieta ed attività.
Anche l’OMS con la carta di OTTAWA si è accorto del potere che un regime alimentare corretto e la giusta attività fisica possono avere nel prevenire il diabete e nel controllarlo, soprattutto nelle sue fasi precoci.
Come vi ho mostrato, quando le cellule beta smettono di produrre insulina, poi non si può fare più nulla, occorre iniziare ad usare insulina esogena come fa un diabetico di tipo 1.
Ad Majora
Leggi anche la prima parte di questo articolo:
https://www.psoriasimetodoapollo.com/meccanismi-della-insulino-resistenza-parte-1/









